
产品货号:
GS2303
中文名称:
多重PCR扩增试剂盒
英文名称:
2×Multiplex PCR Kit
产品规格:
50T|100T
发货周期:
1~3天
产品价格:
询价
本试剂盒中的2×Multiplex PCR Master Mix是一种即用型的溶液,含有dNTP、MgCl2、multiplex PCR Buffer和一些PCR添加剂,能提高扩增效率及减少引物二聚体的形成。用户只需要添加模板,引物,HS Taq DNA Polymerase和水,即可配成PCR反应体系。
提供的HS Taq DNA Polymerase为非活性状态,室温下无聚合酶活性。能有效防止体系配制过程和反应初启动升温过程中非特异性产物和引物二聚体的形成,提高反应效率。HS Taq DNA Polymerase在4min,95℃孵育阶段可被激活。此外,热启动允许反应体系在室温下配制,快速且方便。
2×Multiplex PCR Master Mix中MgCl2终浓度为4mM,适合大多数的多重PCR反应,此外,MgCl2浓度对于引物退火影响很小,所以通常不需要优化Mg2+浓度。

| 组分 | 50T | 100T |
| 2×Multiplex PCR Master Mix | 1.5mL | 2×1.5mL |
| 25mM MgCl2 Solution | 0.5mL | 1mL |
| HS Taq DNA Polymerase(5U/μL) | 50μL | 100μL |
| Sterilized ddH2O | 1mL | 1x2mL |
保存:-20℃,避免反复冻融。

- 模板DNA
多重PCR实验通常比常规PCR实验需要更高含量的模板。起始反应时每个反应体系至少应含有10ng的基因组DNA,或至少1ng不太复杂的DNA(如质粒或病毒DNA)。 - 多重引物设计
为得到最理想的结果,在一次多重PCR实验中,所有PCR产物的长度均应小于1kb。如果PCR产物的长度>1kb,那么需要提高相应的引物浓度。在进行多重PCR反应之前,需要对每一对引物进行单独扩增,验证引物的特异性及扩增效率,根据每对引物的扩增效率来调整每对引物在多重PCR反应体系中的用量。 - 引物浓度
在一次多重PCR反应中,每种引物终浓度通常为50 nM~200 nM。但是,一些引物对扩增效率低于其它引物,提高引物浓度将有助于其扩增。比如,在一次实验中,一个扩增子的得率低于其它扩增子,提高该扩增子的引物浓度将有助于增加其得率。 - 冰上溶解各组分并将所有溶液短暂离心
- 根据下列方法配制10×primer mix(每种引物含有2μM)
成分 用量 引物贮备液浓度 100μM 每种引物 10μL TE Buffer 可调整 总体积 补足至500μL - 根据下表配制一份反应体系
成分 用量 2×Multiplex PCR Master Mix 25μL 10×primer mix(2μM each) 1.25~5μL (50~200 nM) Template DNA 1~500ng HS Taq DNA Polymerase(5U/μL) 1μL Sterilized ddH2O 至50μL - 将反应管置于离心机并离心30~60 s。
- 如果使用的热循环仪没有热盖功能,用矿物油覆盖反应液。
- 将样品放入循环仪中并根据下列循环程序直接开始PCR。
步骤 温度 时间 循环次数 初始变性 95℃ 4min 1 变性 95℃ 30sec 35~40 退火 Tm-5℃ 0.5~1min 延伸 72℃ 1min/kb 终延伸 72℃ 10min 1

- 扩增10个不同区域的人类基因组DNA,10个多重PCR产物长度分别为783,707,641,585,507,438,337,274,224 127bp。
- 根据下表准备反应体系
成分 用量 2×Multiplex PCR Master Mix 12.5μL 10×primer mix(2μM each) 60/80/100nM Human genomic DNA 100ng HS Taq DNA Polymerase(5U/μL) 0.5μL Sterilized ddH2O 补足至25μL - 将反应管放入离心机并离心30~60 s。
- 将样品放入循环仪中并根据下列循环程序开始PCR。
步骤 温度 时间 循环次数 初始变性 95℃ 4min 1 变性 95℃ 30sec 35 退火 60℃ 30sec 延伸 72℃ 1min 终延伸 72℃ 10min 1 - 10个多重PCR产物通过3%琼脂糖凝胶电泳显示(图1)
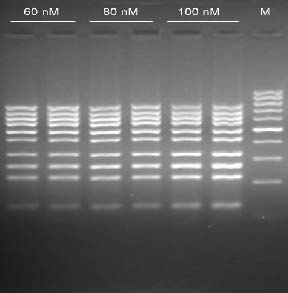
图1.10个多重PCR产物的琼脂糖凝胶电泳,M:DNA Marker H1(100~1000bp)

| 问题 | 可能的原因 | 解决方法 |
| PCR产物少或者没有 | 模板DNA不足 | 根据标准操作步骤提高PCR中模板DNA的含量。 |
| 模板质量差 | 始终使用纯化、完整的高质量DNA作为模板。用琼脂糖凝胶电泳分析模板的完整性。将模板DNA分装储存,避免反复冻融。 | |
| 引物浓度不是最优 | 以50 nM为增量,将引物减少或增加,在50~200 nM范围内优化每种引物的浓度。 | |
| 退火温度过高 | 以2~4℃为增量,降低退火温度。 | |
| PCR产物过长 | 优化过的实验方案允许最长的扩增片段为1kb。 | |
| 检测到其他PCR产物 | 引物设计不完善 | 检查引物设计及其特异性。 |
| 引物降解 | 检查引物浓度和质量。 | |
| 退火温度过低 | 提高退火温度。进行梯度PCR,找到最优的退火温度。 | |
| 循环数太多 | 减少循环次数以排除非特异性产物。 | |
| 一些引物产生的特异性产物不止一个 | 比如在扩增同一个基因组位点的多个DNA片段时,多重的引物之间倾向于结合在就近的与之互补的位置。这样外侧的引物之间组成一对引物能够扩增出更大的片段。 | |
| 模板太多 | 扩增病毒或质粒DNA时,每50μL PCR体系的初始模板浓度不应超过10ng; 扩增基因组DNA时,每50μL PCR体系的初始模板浓度不应超过500ng。 | |
| 扩增到假基因序列 | 引物可能退火到假基因序列上并扩增出额外的PCR产物。检查引物设计避免检测到假基因。 |
相关搜索:多重PCR扩增试剂盒,多重PCR试剂盒,2×Multiplex PCR Kit



